Ozone là chất oxy hóa thân thiện với môi trường
Ozone - Chất Oxy Hóa Thân Thiện Với Môi Trường
Ozone (O3) được coi là chất oxy hóa mạnh và đặc biệt thân thiện với môi trường nhờ khả năng tự phân hủy nhanh chóng sau khi khử khuẩn và xử lý nước.
1. Vì Sao Ozone Thân Thiện Với Môi Trường?
- Ozone sau khi hoàn thành nhiệm vụ diệt khuẩn sẽ nhanh chóng phân hủy trở lại thành oxy (O2).
- Ozone không để lại dư lượng trong nước hay không khí, không gây ô nhiễm thứ cấp.
- Liều lượng ozone sử dụng để khử khuẩn rất nhỏ so với các hóa chất khác.
Phản ứng phân hủy ozone: 2O3 → 3O2 là quá trình tự phát, tỏa nhiệt và giảm năng lượng của hệ thống.
2. Ưu Điểm Ozone So Với Các Chất Oxy Hóa Khác
Theo nghiên cứu, ozone cần liều lượng rất thấp để đạt hiệu quả diệt khuẩn cao:
| Chất Diệt Khuẩn | Liều Lượng (mg.phút/L) | 2-log (99%) | 3-log (99,9%) | 4-log (99,99%) |
|---|---|---|---|---|
| Clo | - | 3 | 4 | 6 |
| Cloramin | - | 643 | 1067 | 1491 |
| Clo Dioxit | - | 4,2 | 12,8 | 25,1 |
| Ozone | - | 0,5 | 0,8 | 1 |
Nguồn: Lentech - Phép đo thực hiện tại T=10°C, pH ~6-9.
Liên quan: Ozone trong xử lý nước thải
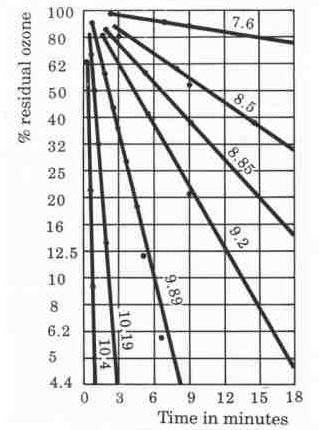
3. Thời Gian Phân Hủy Nhanh Của Ozone
Ozone có thời gian bán phân hủy ngắn, đặc biệt trong nước:
| Môi Trường | Nhiệt Độ (°C) | Thời Gian Bán Phân Hủy |
|---|---|---|
| Không Khí | 20 | 3 ngày |
| Không Khí | 120 | 90 phút |
| Nước | 30 | 12 phút |
| Nước | 35 | 8 phút |
Thời gian phân hủy ozone trong nước thường ngắn hơn không khí vì ozone dễ bị tiêu hao khi phản ứng với các ion hydroxit (OH-).
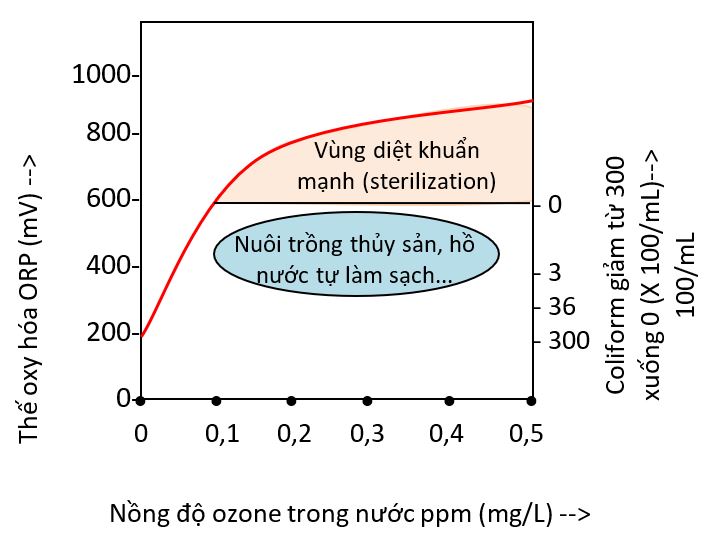
4. Tại Sao Ozone Được Ưa Chuộng Trong Xử Lý Nước Và Không Khí?
- Diệt khuẩn, diệt virus hiệu quả trong thời gian ngắn.
- Không để lại dư lượng độc hại sau quá trình xử lý.
- Phân hủy nhanh chóng thành oxy an toàn cho môi trường.
- Liều lượng sử dụng thấp, tiết kiệm chi phí vận hành.
Xem thêm: Máy tạo ozone công nghiệp
5. Kết Luận
Ozone là chất oxy hóa mạnh, có hiệu quả diệt khuẩn nhanh, không gây tồn dư trong môi trường và tự phân hủy hoàn toàn thành oxy an toàn. Đây là lý do ozone được đánh giá là chất oxy hóa thân thiện với môi trường và ngày càng được ứng dụng rộng rãi trong xử lý nước, thực phẩm và không khí.
Tham khảo thêm tại: www.thietbibkidt.vn