CÁC YẾU TỐ ẢNH HƯỞNG TỚI SỰ PHÂN HỦY CỦA OZONE TRONG NƯỚC.
Các yếu tố ảnh hưởng tới sự phân hủy của ozone trong nước
Ozone là một hợp chất không ổn định với thời gian bán rã ngắn, đặc biệt là trong nước. Việc ozone phân hủy nhanh chóng trong nước khiến quá trình xử lý nước cần được kiểm soát chặt chẽ các yếu tố ảnh hưởng để đạt hiệu quả tối ưu.
1. Ảnh hưởng của nhiệt độ
Nhiệt độ là yếu tố quan trọng quyết định tốc độ phân hủy ozone. Khi nhiệt độ tăng, khả năng hòa tan ozone giảm, tốc độ phản ứng tăng mạnh, dẫn đến ozone phân hủy nhanh hơn. Dưới đây là bảng so sánh thời gian bán rã của ozone trong không khí và trong nước ở các mức nhiệt độ khác nhau:
Bảng 1: Thời gian bán rã của ozone trong không khí và nước
| Không khí | Thời gian bán rã | Nước (pH = 7) | Thời gian bán rã |
|---|---|---|---|
| -50°C | 3 tháng | 15°C | 30 phút |
| -35°C | 18 ngày | 20°C | 20 phút |
| -25°C | 8 ngày | 25°C | 15 phút |
| 20°C | 3 ngày | 30°C | 12 phút |
| 120°C | 1,5 giờ | 35°C | 8 phút |
| 250°C | 1,5 giây | - | - |
Ozone không nên được sử dụng cho nước có nhiệt độ trên 40°C do thời gian bán rã cực kỳ ngắn.
2. Ảnh hưởng của pH
Ozone phân hủy nhanh hơn trong môi trường có pH cao. Khi pH tăng, các ion hydroxide (OH-) thúc đẩy phản ứng phân hủy ozone, tạo ra các gốc OH tự do mạnh mẽ hơn.
Phản ứng chính:
- O3 + OH- → HO2- + O2
- O3 + HO2- → •OH + O2•- + O2
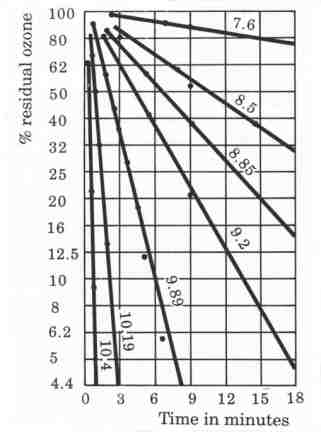
Hình 1: Ảnh hưởng của pH đến sự phân hủy của ozone (T = 15°C)
3. Nồng độ chất rắn hòa tan
Ozone phản ứng với các chất hữu cơ, vi khuẩn và virus trong nước. Sự hiện diện của các chất này làm ozone phân hủy nhanh hơn. Thời gian bán rã của ozone trong nước cất ngắn hơn so với nước có nhiều tạp chất.
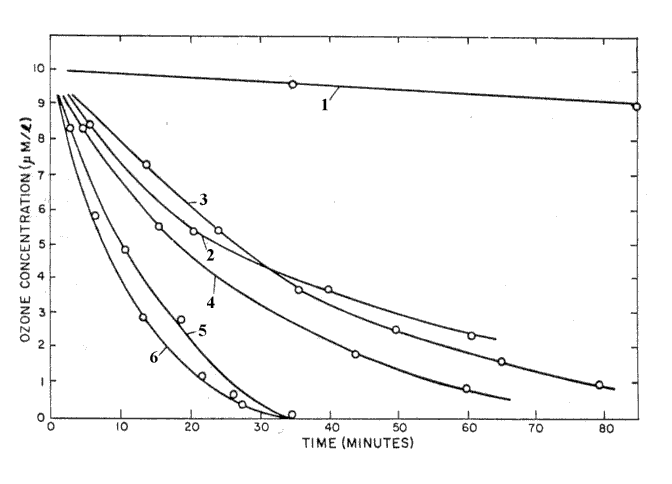
Hình 2: Ozone phân hủy trong các loại nước khác nhau ở 20°C
4. Ảnh hưởng của cacbonat và bicacbonat
Cacbonat (CO32-) và bicacbonat (HCO3-) là các chất ức chế làm chậm sự phân hủy của ozone. Chúng phản ứng nhanh với OH gốc tự do, giảm tốc độ oxy hóa.
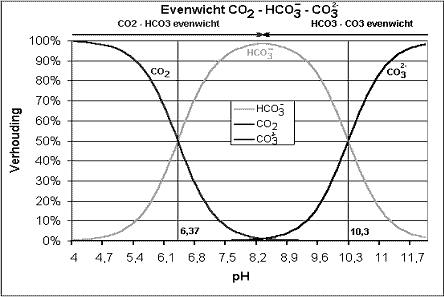
Hình 3: Cân bằng cacbonat, bicacbonat và CO2
5. Ảnh hưởng của vật liệu hữu cơ tự nhiên (NOM)
Vật liệu hữu cơ tự nhiên (NOM) trong nước, thường được đo bằng chỉ số carbon hữu cơ hòa tan (DOC), có thể thúc đẩy hoặc làm chậm sự phân hủy ozone. Tùy thuộc vào loại NOM, chúng có thể phản ứng trực tiếp với ozone hoặc với OH gốc tự do.
Việc đánh giá sự ổn định của ozone trong nước tự nhiên là rất khó do ảnh hưởng phức tạp của các hợp chất hữu cơ trong nước.